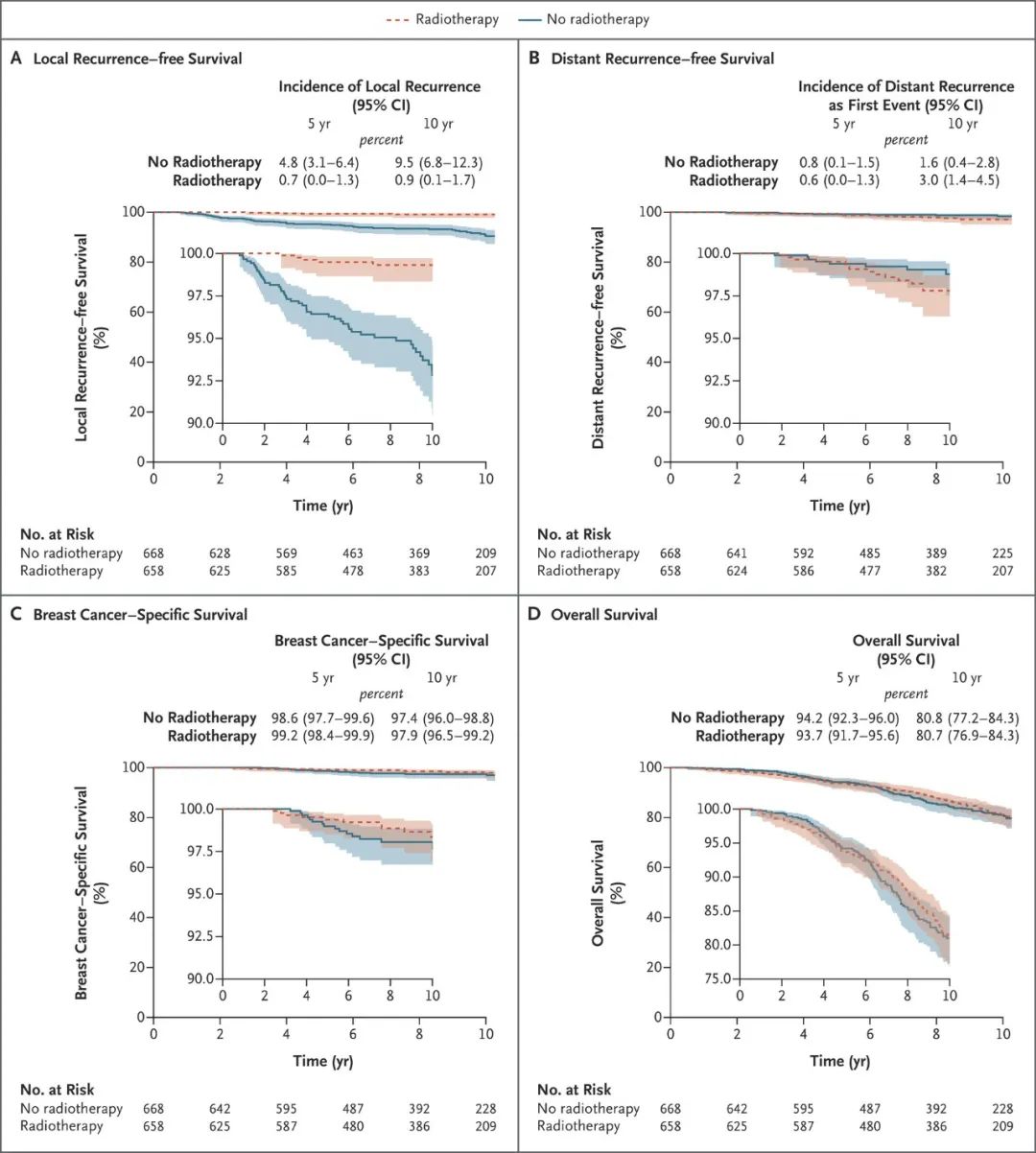
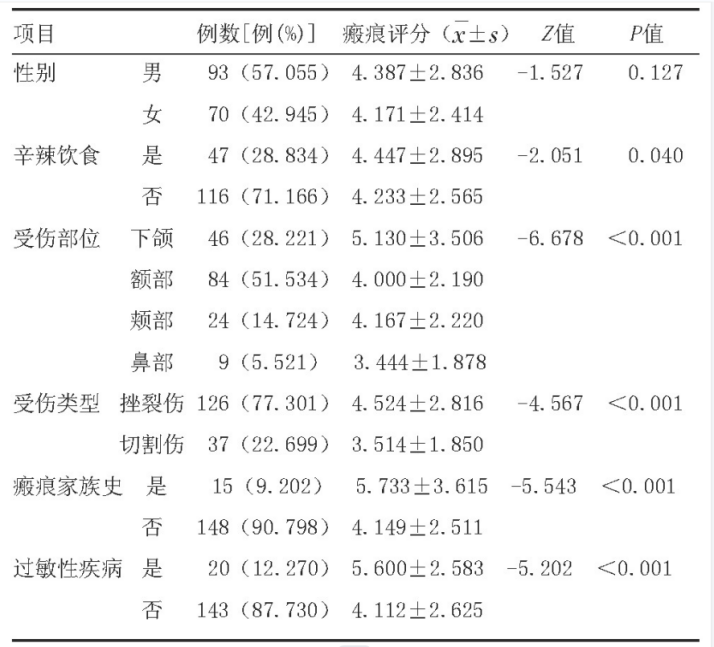
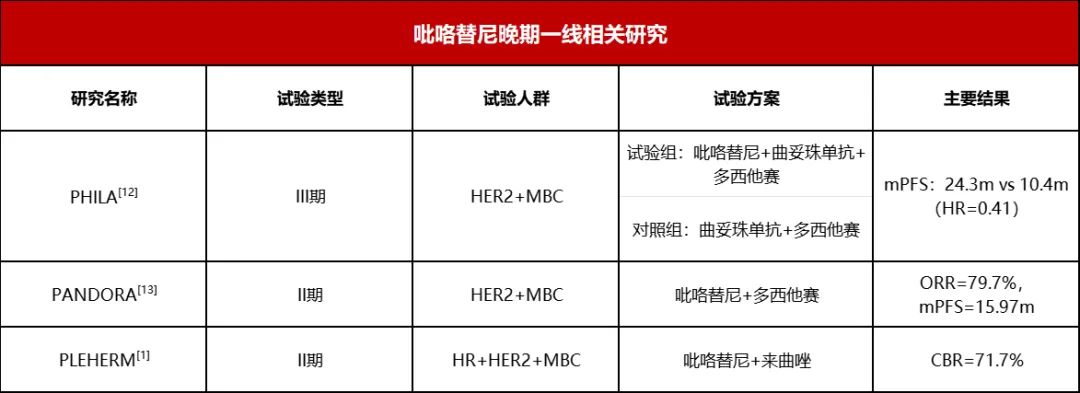
吕丹,吴云,马飞(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院 肿瘤内科,北京 100021) 乳腺癌的诊疗水平逐年提高,5年生存率已高达90%[1],远超其他恶性肿瘤。乳腺癌的全身治疗已初步形成包括化疗、靶向治疗、内分泌治疗和免疫治疗在内的成熟体系。近年来“精准治疗”逐渐受到重视,个体化制定治疗策略,能进一步改善乳腺癌患者的预后和提高患者生活质量。本文将从化疗、靶向治疗、内分泌治疗和免疫治疗等方面总结乳腺癌领域过去一年的重大进展,并对乳腺癌未来治疗的研究方向进行展望,以便更好地指导乳腺癌个体化精准治疗。 化疗是乳腺癌各个阶段治疗中的重要组成部分,多项研究证实化疗可延长生存、改善预后,但化疗不良反应较重、容易耐药等仍是目前亟待解决的问题。 三阴性乳腺癌(triple-negative breast cancer,TNBC)新辅助治疗的标准方案是基于蒽环-紫杉的方案,NeoCART研究[2]探索铂类药物的加入是否能提升病理完全缓解(pathologic complete response,pCR)率。研究对比多西他赛联合卡铂与标准新辅助化疗方案治疗TNBC的疗效及安全性,发现无论是在总人群还是不同淋巴结状态或不同肿瘤分期的亚组中,多西他赛+卡铂(DCb)方案较标准的EC-D(4周期表柔比星+环磷酰胺,序贯4周期多西他赛)方案显示出更高的pCR率,且两组患者的不良反应发生率比较无统计学意义,这提示DCb方案有希望成为TNBC新辅助治疗新的选择,但生存结果仍需要长期随访数据验证。 ECOG-ACRIN EA1131 Ⅲ期临床研究纳入410例新辅助化疗后仍有残留浸润性疾病(residual invasive disease,RD)的TNBC患者,术后随机接受铂类(卡铂或顺铂,第1天,3周1个周期,共4个周期)或卡培他滨(第1~14天,3周1个周期,共6个周期)治疗[3]。TNBC亚型(基底型和非基底型)由残留疾病中的PAM50确定。研究采用非劣效性设计,在308例基底亚型TNBC患者中,铂类组患者3年无浸润性疾病生存(invasive disease free survival,iDFS)率为42%,卡培他滨组患者iDFS率为49%。铂类药物治疗中的3/4级不良反应更为常见。与卡培他滨相比,铂类药物并不能改善基底亚型TNBC RD患者新辅助化疗后的预后,且与更严重的不良反应相关。因此,数据和安全监察委员会最终建议停止该试验。 cabazitaxel是一种新型抗微管类药物。2021年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)会议公布了一项对比cabazitaxel 3周方案与紫杉醇周疗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性转移性乳腺癌的Ⅱ期研究,共纳入158例患者,cabazitaxel组和紫杉醇组患者中位无进展生存(progress free survive,PFS)时间分别为6.7个月和5.8个月,中位总生存(overall survival,OS)时间分别为19.3个月和20.0个月,客观缓解率(objective response rate,ORR)分别为42%和37%,两组比较差异均无统计学意义。两组任何级别周围神经病变发生率分别为17%和55%,cabazitaxel组患者具有更好的生活质量(quality of life,QoL)[4]。cabazitaxel一线治疗虽未显著改善患者PFS时间,但是周围神经病变风险更低,耐受性较好,cabazitaxel能否替代紫杉醇成为HER2阴性转移性乳腺癌一线治疗选择仍需要更多的临床数据来支持。 2.1 HER2阳性乳腺癌靶向治疗 靶向治疗贯穿HER2阳性乳腺癌的治疗全程,包括新辅助治疗、术后辅助治疗及晚期解救治疗。从过去单一的曲妥珠单抗,到Apatinib/ target=_blank class=infotextkey>LApatinib/ target=_blank class=infotextkey>拉帕替尼、吡咯替尼和恩美曲妥珠单抗(tRAStuzumab emtansine,T-DM1)的出现,乳腺癌靶向治疗已取得了突破性进展。 2.1.1 新辅助治疗 吡咯替尼是一种新型的不可逆泛ErbB受体酪氨酸激酶抑制剂。PHOEBE Ⅲ期研究[5]表明,吡咯替尼可显著延长HER2阳性晚期乳腺癌患者PFS时间,但其在新辅助治疗阶段的疗效和安全性仍有待探索。HR-BLTN-Ⅲ-NeoBC研究是一项吡咯替尼联合曲妥珠单抗加多西他赛对比安慰剂联合曲妥珠单抗加多西他赛新辅助治疗HER2阳性乳腺癌的Ⅲ期临床研究,主要终点为总体病理完全缓解(total pathologic complete response,tpCR),结果显示治疗组患者tpCR率显著高于对照组(71.4%∶36.7%,P<0.05),两组患者腹泻发生率分别为28.6%和10.0%[6]。该研究提示,在多西他赛和曲妥珠单抗的基础上联用吡咯替尼的新辅助治疗能够显著提高患者的tpCR率,且安全性可控。 2.1.2 术后辅助治疗 目前,对于HER2阳性早期乳腺癌患者而言,12个月的曲妥珠单抗辅助治疗是标准方案,但有研究结果发现,对于低危患者缩短疗程治疗(6个月或9周)也能使患者获得较好的生存。2021年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)大会公布了5项曲妥珠单抗辅助治疗短疗程非劣效随机对照研究的Meta分析[7],以探索缩短单药辅助曲妥珠单抗治疗HER2阳性早期乳腺癌的治疗疗程,结果显示治疗12个月和6个月患者的5年iDFS率分别为89.26%和88.56%(校正后HR=1.07,非劣效性P=0.02)。而治疗12个月对比9周,患者5年iDFS率分别为91.40%和89.22%(校正后HR=1.27,非劣效性P=0.56)。曲妥珠单抗辅助治疗持续6个月的疗效不劣于12个月,但9周的疗效未达到非劣效。早期低危患者的术后靶向治疗,相较于治疗6个月,治疗12个月可能仅能带来0.7%的获益,然而目前对于能够缩短抗HER2靶向治疗时间的低风险人群,仍有待进一步探索。 2.1.3 晚期解救治疗 HER2阳性晚期乳腺癌一直受到临床的关注,近年来新药不断涌现,美国食品和药品监督管理局已经批准了一系列抗HER2药物,包括小分子药物如Lapatinib/ target=_blank class=infotextkey>拉帕替尼、奈拉替尼、tucatinib,抗HER2大分子单抗如曲妥珠单抗、帕妥珠单抗,抗体药物偶联物(antibody-drug conjugate,ADC)如T-DM1和tRAStuzumab deruxtecan(T-DXd,T-DXd)/ target=_blank class=infotextkey>DS-8201)等,使得晚期乳腺癌的治疗水平不断提升,从既往PFS时间的改善,到现在OS时间的延长,为患者带来切实的获益。 2021年ESMO大会上公布了DESTINY-Breast 03 Ⅲ期研究结果,首次将T-DXd和T-DM1进行头对头对比[8]。T-DXd组研究者评估的中位PFS时间显著优于T-DM1组(25.1个月∶7.2个月),OS具有优效性趋势(12个月OS率94.1%∶85.9%),两组患者ORR分别为79.7%和34.2%。亚组分析也很一致,无论既往是否接受帕妥珠单抗治疗、内脏转移与否、前线治疗线数等,T-DXd组患者均具有一致性的PFS时间获益,对于脑转移患者,T-DXd组患者PFS时间为15.0个月,显著优于T-DM1组的5.7个月;不良反应方面,T-DXd组任何级别间质性肺炎发生率为10.5%,未出现4~5级间质性肺炎。本研究数据支持T-DXd成为HER2阳性转移性乳腺癌的二线标准治疗。 T-DM1的全球关键性研究EMILIA研究[9]证实,与拉帕替尼联合卡培他滨治疗相比,T-DM1可显著延长HER2阳性晚期乳腺癌二线治疗患者的PFS和OS时间,且毒性更小。2021年ESMO大会最新公布了EMILIA研究亚洲人群数据。结果显示在158例亚洲人群中,与拉帕替尼+卡培他滨相比,T-DM1显著延长了患者的PFS时间(9.3个月∶6.9个月)和OS时间(34.3个月∶22.7个月),同时在亚洲患者中未发现新的安全性问题,但亚洲人群中T-DM1组患者3~4级血小板减少症的发生率增加(39.3%∶13.9%)[10]。因此,EMILIA研究的亚洲人群患者数据结果与全球人群一致,为亚洲患者临床实践带来更多借鉴意义。 trastuzumab duocarmazine(SYD985)是一种新型HER2靶向ADC,由曲妥珠单抗与杜卡霉素(vc-seco-DUBA)偶联而成。TULIP研究将既往接受过≥2种晚期乳腺癌治疗方案或既往接受过T-DM1治疗的HER2阳性局部晚期或转移性乳腺癌患者随机分至SYD985组和医生选择化疗组,主要终点为试验室评估的中位PFS时间,结果显示SYD985组患者中位PSF时间显著长于PC组(7.0个月∶4.9个月)。眼部毒性是最常见的安全性事件[11]。SYD985可作为既往经治的局部晚期或转移性HER2阳性乳腺癌患者的治疗新选择。 维迪西妥单抗(RC48-ADC)是中国第一个创新HER2靶向ADC,其偶联的化疗药物甲基澳瑞他汀E直接强效杀伤HER2表达肿瘤细胞,同时针对异质性肿瘤细胞具有旁观者效应。2021年ASCO会议报道了维迪西妥单抗治疗HER2阳性及HER2低表达晚期乳腺癌数据,HER2阳性患者的ORR为42.9%,中位PFS时间为6.6个月;HER2低表达组患者ORR为39.6%,中位PFS时间为5.7个月[12]。最常见的不良反应为转氨酶升高、白细胞减少和感觉减退。研究表明,HER2阳性和HER2低表达晚期乳腺癌均能从维迪西妥单抗治疗中获益。 2.2 TNBC靶向治疗 多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]抑制剂通过合成致死作用,有效抑制同源重组缺陷(homologous recombination deficiency,HRD)的肿瘤细胞。在TNBC中,乳腺癌易感基因(breast cancer susceptibility gene,BRCA)基因突变是导致HRD的原因之一。奥拉帕利是一种口服PARP抑制剂,OlympiA研究[13]证实了奥拉帕利单药治疗胚系BRCA突变HER2阴性晚期乳腺癌患者的生存获益。2021年ASCO会议上公布了OlympiA研究PARP抑制剂在辅助治疗阶段的数据,结果发现在胚系BRCA突变/HER2阴性高危早期乳腺癌患者中,完成局部治疗和新辅助或辅助化疗后,奥拉帕利辅助治疗的3年iDFS率显著高于安慰剂(85.9%∶77.1%),绝对获益达到8.8%,3年OS率显示出获益趋势(92.0%∶88.3%),绝对获益率为3.7%,目前尚未达到统计学意义,有待更长时间的随访。该研究奠定了BRCA基因作为早期乳腺癌治疗靶点的重要地位,也表明了奥拉帕利是一种可选择的辅助治疗强化策略。 目前,PARP抑制剂在新辅助治疗领域内还没有大型研究报道。NEOTALA Ⅱ期单臂研究探讨了另一种PARP抑制剂talazoparib用于新辅助治疗胚系BRCA1/2突变的早期HER2阴性乳腺癌的有效性与安全性,结果显示主要研究重点pCR率为45.8%,且耐受性良好[14]。在BRCA突变人群,PARP抑制剂在无化疗帮辅下显现了较好的抑制肿瘤疗效,但其结论仍需进一步Ⅲ期临床研究的证实。 pamiparib/ target=_blank class=infotextkey>帕米帕利是对PARP1/2酶具有强效高选择性的PARP抑制剂,且对P糖蛋白介导的耐药通路存在抗耐药性。2021年ASCO年会一项关于pamiparib/ target=_blank class=infotextkey>帕米帕利在携有胚系BRCA基因突变的局部晚期或转移性HER2阴性乳腺癌患者中的疗效的Ⅱ期临床研究显示,帕米帕利在激素受体(hormone receptor,HR)阳性/HER2阴性组的ORR为61.9%,在TNBC组ORR为38.2%[15]。该研究是目前公布的首个针对中国乳腺癌患者PARP抑制剂疗效和安全性数据的临床研究,进一步确认了PARP抑制剂用于中国人群的治疗疗效和安全性。 人滋养层细胞表面抗原2(human trophoblast cell-surface antigen 2,Trop-2)在TNBC细胞高表达,约占80%,而在正常细胞中表达非常低。靶向Trop-2的药物sacituzumab govitecan(SG)是由抗Trop-2人源单克隆抗体与细胞毒性代谢物SN-38(伊立替康的活性代谢产物)偶联而成的第三代ADC。ASCENT Ⅲ期研究发现,SG相较于单独化疗显著延长转移性TNBC患者PFS时间(5.6个月∶1.7个月)和OS时间(12.1个月∶6.7个月),其最常见的不良反应为血液学和消化道毒性[16]。2021年ESMO大会报道的ASCENT研究结果显示,相较于化疗,SG可显著改善患者健康相关生活质量[17]。SG对患者的全球健康状况指数、躯体、情绪、疲劳、疼痛、呼吸困难、失眠等症状的改善均显著优于化疗,这提示对于接受≥2线治疗的晚期TNBC患者,与化疗相比,SG不仅可显著延长患者PFS时间、OS时间,还可维持或改善生活质量。 内分泌治疗是乳腺癌的重要治疗策略之一,主要适用于HR阳性的乳腺癌患者,包括早期患者的辅助内分泌治疗和晚期患者的解救内分泌治疗。需要长期辅助治疗或维持治疗的患者更加适合进行内分泌治疗。 3.1 新辅助内分泌治疗 新辅助内分泌治疗作为治疗激素依赖性乳腺癌的潜在替代方式逐渐受到重视。giredestrant是新型口服选择性雌激素受体(estrogen receptor,ER)下调剂,能够与ER高效结合,阻断ER信号通路传导,从而抑制肿瘤生长[18]。coopERA BC研究的目的是评估giredestrant用于ER阳性、HER2阴性早期乳腺癌新辅助内分泌治疗的疗效。中期分析数据表明在治疗2周后,与阿那曲唑+Palbociclib/ target=_blank class=infotextkey>哌柏西利组相比,giredestrant+Palbociclib/ target=_blank class=infotextkey>哌柏西利组在Ki-67指数平均下降率(80.0%∶67.0%)和细胞周期完全停止率(25.0%∶5.1%)均显现出优势[19],为细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4 and 6,CDK4/6)抑制剂联合内分泌治疗应用于乳腺癌新辅助内分泌治疗提供了新的依据。除此之外,有关giredestrant在乳腺癌辅助内分泌治疗以及晚期乳腺癌治疗的研究也正在进行中,为ER阳性乳腺癌患者带来了新的治疗选择。 3.2 辅助内分泌治疗 辅助内分泌治疗是早期乳腺癌治疗的重要组成部分,强化辅助内分泌治疗则可以进一步降低乳腺癌患者的复发风险,延长患者的无病生存期和OS时间。芳香化酶抑制剂(aromatase inhibitor,AI)是绝经后HR阳性乳腺癌患者辅助内分泌治疗的首选,延长AI内分泌治疗时间,能否为患者带来获益仍存在争议。Gruppo Italiano Mammella(GIM)研究是一项前瞻性、开放性、Ⅲ期临床试验,旨在确定绝经后早期乳腺癌患者接受Tamoxifen/ target=_blank class=infotextkey>他莫昔芬治疗2~3年后,来曲唑5年是否优于来曲唑治疗的标准持续时间2~3年。中位随访11.7年结果显示,2~3年Tamoxifen/ target=_blank class=infotextkey>他莫昔芬治疗后,序贯来曲唑5年较来曲唑2~3年可显著提高患者无病生存(disease free survival,DFS)率(67.0%∶62.0%)和OS率(88.0%∶84.0%)[20]。提示存在乳腺癌复发风险的患者接受2~3年他莫昔芬治疗后序贯5年来曲唑治疗是一种可选择的标准治疗方式。另外一项AI延长治疗的经典研究是NSABP B-42,随访10年数据显示延长5年来曲唑治疗组较安慰剂组取得了绝对获益[21]。为精准地寻找到适合进行延长内分泌治疗的人群,研究者通过乳腺癌指数(breast cancer index,BCI)和70基因检测(70-MP)复发风险模型对延长AI治疗获益人群进行预测。结果提示淋巴结阳性和他莫昔芬续贯来曲唑内分泌治疗的高BCI-H/I组患者延长4年以上AI治疗可显著降低远处复发率。70-MP评分0~0.355的患者在延长来曲唑治疗后,其远处复发、DFS和无乳腺癌间隔期获益均有统计学意义[22]。 CDK4/6抑制剂联合内分泌治疗是强化辅助内分泌治疗的另一种可行手段。monarchE研究发现在HR阳性、HER2阴性的高危早期乳腺癌患者中,与单纯内分泌治疗相比,阿贝西利联合内分泌治疗可显著改善患者iDFS,为高危早期乳腺癌患者阿贝西利联合辅助内分泌强化治疗策略提供了依据[23]。2021年ASCO会议报道了monarchE研究中国患者部分的疗效和安全性分析[24],结果显示与全球人群一致。与单纯内分泌治疗相比,阿贝西利联合内分泌治疗使中国患者发生侵袭性疾病或死亡的风险降低了34.3%,2年iDFS率提高3.5%(95.6%∶92.1%)。在对monarchE研究中接受过新辅助化疗的人群进行探索性分析发现,阿贝西利联合内分泌治疗组患者的2年iDFS率为87.2%,单用内分泌治疗组为80.6%,获益较意向治疗分析(intention to treat analysis,ITT)人群更大[25]。提示在接受新辅助化疗的患者中,阿贝西利联合内分泌治疗可能较ITT人群具有更大临床意义的治疗获益。 3.3.1 联合CDK4/6抑制剂 CDK4/6抑制剂联合内分泌治疗已经成为HR阳性、HER2阴性晚期乳腺癌的标准治疗策略。目前已经开展的PALOMA-2、MONALESSA-2、MONARCH-3和MONALESSA-7等研究均证实与单纯AI治疗相比,CDK4/6抑制剂联合内分泌治疗方案可显著降低疾病进展风险[26]。MONALEESA-2是探索ribociclib联合来曲唑治疗绝经后HR阳性、HER2阴性晚期乳腺癌的多中心Ⅲ期研究。2021年EMSO会议公布了最新的随访数据,结果显示,与安慰剂+来曲唑组相比,ribociclib+来曲唑组患者中位OS时间显著延长12.5个月(63.9个月∶51.4个月)[27]。PALOMA-2研究亚组分析表明,哌柏西利+来曲唑一线治疗ER阳性、HER2阴性绝经后亚洲晚期乳腺癌患者可能有效[28]。PALOMA-4研究通过Ⅲ期试验进一步证实哌柏西利+来曲唑在亚洲患者中可以取得显著中位PFS时间获益(21.5个月∶13.9个月)[29]。 PALOMA-3、MONARCH-2和MONALEESA-3研究均显示,CDK4/6抑制剂联合氟维司群在既往内分泌治疗失败乳腺癌中显示出了较好的治疗效果[30-32]。2021年ASCO会议更新了PALOMA-3研究随访73.3个月的数据[33],结果显示接受哌柏西利+氟维司群治疗的患者有持续的生存获益(34.8个月∶28.0个月)。同时,研究还通过循环肿瘤DNA分析,发现在ESR1突变的患者中,哌柏西利+氟维司群联合方案组可改善患者的OS时间(27.7个月∶20.2个月)。MONALEESA-3研究也更新了随访56.3个月的数据,同样印证了ribociclib联合氟维司群治疗可显著延长绝经后HR阳性、HER2阴性晚期乳腺癌患者的OS时间(53.7个月∶41.5个月)[34]。 dalpiciclib是一种在分子结构上进行了重构优化的新型CDK4/6抑制剂,DAWNA-1研究显示,在内分泌治疗后疾病进展的HR阳性、HER2阴性晚期乳腺癌患者中dalpiciclib联合氟维司群与安慰剂联合氟维司群相比,PFS时间显著延长8.0个月(15.7个月∶7.2个月),进展或死亡风险减少58%[35]。dalpiciclib联合氟维司群也成为HR阳性、HER2阴性晚期乳腺癌患者的二线治疗新选择。PEARL研究评估了绝经后AI治疗失败的HR阳性、HER2阴性晚期乳腺癌中CDK4/6抑制剂联合内分泌治疗对比化疗的疗效,前期结果显示哌柏西利+氟维司群治疗的PFS时间并不优于卡培他滨。2021年ESMO大会报告的OS数据同样未体现出哌柏西利+内分泌治疗组相较于卡培他滨组的获益优势[36]。提示对于内分泌耐药人群,化疗依然是三线及多线治疗后HR阳性、HER2阴性晚期乳腺癌患者的优选。 内分泌治疗联合抗HER2靶向治疗已被证实是HR阳性、HER2阳性晚期乳腺癌患者的可选方案之一。2021年ACSO会议报告了一项来曲唑、吡咯替尼联合dalpiciclib一线或二线治疗HR阳性、HER2阳性晚期乳腺癌患者的Ⅰb期临床研究,结果显示ORR达到66.7%,疾病控制率为93.3%[37],为HR阳性、HER2阳性晚期乳腺癌患者提供了一个化疗保留的可能治疗选择。 3.3.2 联合PI3K/Akt/mTOR抑制剂 磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路活化与乳腺癌治疗耐药密切相关。TAMRAD、BOLERO-2、PrE0102等研究均证实了依维莫司联合内分泌治疗较单纯内分泌治疗能取得更多的PFS获益[38,39]。BOLERO-5研究设计与BOLERO-2研究类似,旨在评价依维莫司+依西美坦治疗中国绝经后ER阳性、HER2阴性晚期乳腺癌的效果[40],其疗效和安全性结果再一次验证了BOLERO-2研究的结果,进一步支持依维莫司+依西美坦在中国绝经后ER阳性、HER2阴性晚期乳腺癌患者中的应用。约60%的中国乳腺癌患者为绝经前女性,MIRACLE研究探索了依维莫司联合来曲唑与单独使用来曲唑在绝经前HR阳性、HER2阴性晚期乳腺癌女性患者中的疗效。结果显示相较于来曲唑单药治疗,依维莫司联合来曲唑可显著延长PFS时间8.2个月(19.2个月∶11.0个月),获益程度与CDK4/6抑制剂相当[41]。在依维莫司取得较好疗效的同时,口腔黏膜炎、间质性肺炎等不良反应也较为突出。DESIREE研究通过应用依维莫司剂量递增方式来探索能否减少口腔黏膜炎的发生。2021年ESMO大会报告显示,使用依维莫司3周以上的剂量递增方案可成功预防HR阳性、HER2阴性晚期乳腺癌患者2级以上黏膜炎发作,且疗效不受影响[42]。 taselisib是一种口服的靶向α、δ、γ亚型PI3K抑制剂,研究发现其与他莫昔芬联用显示出临床抗肿瘤活性[43]。POSEIDON研究旨在探索在既往接受内分泌治疗后的HR阳性、HER2阴性晚期乳腺癌患者中评估他莫昔芬+taselisib或他莫昔芬+安慰剂的疗效。他莫昔芬+taselisib可将患者的中位PFS时间从3.2个月延长至4.8个月,但taselisib耐受性较差,44%的患者发生3级以上不良事件,OS数据尚未公布[44]。 近年来,以免疫检查点抑制剂为代表的免疫治疗在TNBC中不断取得重大突破,多项临床研究证实,不论是靶向程序性死亡蛋白-1(programmed death-1,PD-1)/程序性死亡蛋白配体1(programmed death ligand-1,PD-L1)抑制剂单药还是联合化疗治疗TNBC均呈现出较好的生存获益。 4.1 早期乳腺癌 KEYNOTE-522研究首次尝试将免疫治疗前移至新辅助治疗阶段。2021年ESMO大会公布了KEYNOTE-522研究的生存随访结果,无论是在PD-L1+/-还是在总体人群,化疗联合帕博利珠单抗新辅助方案较单纯化疗能够显著提高pCR率,并且在之后的辅助治疗阶段继续使用帕博利珠单抗较安慰剂能够提高无事件生存率(84.5%∶76.8%),为早期TNBC治疗打开了新局面[45]。 GeparNuevo研究旨在探讨TNBC患者在紫杉类药物序贯蒽环类药物新辅助化疗的基础上联合度伐利尤单抗的疗效。在前期报告中,度伐利尤单抗治疗组与安慰剂组pCR率比较差异并无统计学意义。2021年ASCO会议报道了GeparNuevo研究随访43.7个月的结果,度伐利尤单抗治疗组患者3年iDFS、DFS和OS均显著优于安慰剂组[46],首次提供了免疫治疗联合化疗治疗早期TNBC患者长期生存结局的证据。另一项单臂、Ⅱ期卡瑞利珠单抗联合白蛋白紫杉醇和表柔比星新辅助治疗TNBC的研究也显示PD-1抑制剂联合化疗能为早期TNBC患者带来较高的tpCR率,但仍需要进一步的研究予以验证[47]。虽然目前免疫治疗为TNBC患者带来曙光,但关于新辅助化疗联合免疫治疗的获益人群、用药方案和顺序及是否需要在辅助治疗中继续使用免疫治疗等问题仍需要进一步探索。 4.2 晚期乳腺癌 IMpassion130研究是第一个在晚期TNBC中证实一线应用免疫治疗有效的Ⅲ期临床研究。2021年ASCO会议报道了探索性分析IMpassion130研究生物标志物的结果,在PD-L1阳性炎症型和豁免型的肿瘤中,与安慰剂联合白蛋白紫杉醇组相比,阿替利珠单抗联合白蛋白紫杉醇组患者PFS改善,但OS改善仅限于PD-L1阳性炎症型患者。PD-L1阳性基底样免疫激活可带来OS获益,而PFS获益则存在于免疫抑制和免疫激活亚型[48]。然而随后IMpassion131研究却发现阿替利珠单抗联合紫杉醇却无法使TNBC患者获益[49],截然不同的研究结果值得深入思考。中国学者通过整合单细胞转录组测序等方法对TNBC患者肿瘤微环境进行深入探索,发现了对免疫治疗良好应答患者特异性的免疫微环境特征,同时发现紫杉醇可能会削弱核心抗肿瘤免疫细胞,紫杉醇化疗方案与阿替利珠单抗联合应用时,会影响阿替利珠单抗对TNBC患者的治疗效果,为IMpassion131研究的阴性结果提供了理论依据,也为TNBC的精准免疫治疗提供了新的思路[50]。 KEYNOTE-355研究探索了帕博利珠单抗联合化疗对比安慰剂联合化疗一线治疗TNBC的临床疗效。前期结果证实对于联合阳性评分≥10分的TNBC患者,与安慰剂联合化疗相比,帕博利珠单抗联合化疗可显著改善患者的PFS。2021年ESMO大会报告了该研究中位随访44.1个月的结果,与安慰联合化疗相比,帕博利珠单抗联合化疗可显著延长联合阳性评分≥10的TNBC患者OS时间达6.9个月,ORR提高11.9%,PFS与前期获得的显著性获益一致[51]。双主要终点的获益再次证明了帕博利珠单抗联合化疗在转移性TNBC一线治疗中的价值。 2021年乳腺癌在临床研究及转化研究领域都取得了多项突破性进展,但仍面临诸多挑战。在蒽环类、紫杉类等药物为患者带来生存获益的同时,随之而来的也有不同程度上的不良反应,因此寻找高效、低毒的化疗药物仍然是当今研究人员的首要任务。ADC类药物作为抗肿瘤治疗的新兴药物,有其独特的作用机制。目前T-DM1、DS-8201以及国产ADC类药物维迪西妥单抗等都已经在乳腺癌治疗中显示出良好疗效,继续优化临床治疗方案包括对患者的筛选、剂量和周期的选择、联合用药方案以及不良反应的管理仍有待于进一步探索。在内分泌治疗中,明确新辅助内分泌治疗合适的药物和给药方式,合理的利用基因测序技术筛选辅助内分泌治疗患者豁免化疗、克服逆转内分泌耐药以及对晚期内分泌治疗药物合理的排兵布阵,仍是未来探索的方向。免疫治疗为TNBC患者带来新的治疗选择,但目前仍缺乏免疫治疗优势人群以及免疫治疗疗效预测生物标志物的筛选标准,最佳的联合治疗方案仍有待于优化。 期待未来有更多创新型药物不断研发,越来越多的临床、基础及转化研究数据为临床决策提供支持,为乳腺癌患者带来更多获益! 参考文献 1. ALLEMANI C, MATSUDA T, DI CARLO V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37?513?025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125):1023-1075. 2. ZHANG L, WU ZY, LI J, et al. Neoadjuvant docetaxel plus carboplatin vs epirubicin plus cyclophosphamide followed by docetaxel in triple-negative, early-stage breast cancer (NeoCART): Results from a multicenter, randomized controlled, open-label phase Ⅱ trial[J]. Int J Cancer, 2021. Epub ahead of print. 01 化学治疗

02 靶向治疗
03 内分泌治疗
3.3 晚期乳腺癌内分泌治疗
04 免疫治疗
05 总结与展望